本试剂盒适合于从褐土、淤泥、火山灰等各种极端土壤环境中提取微生物 DNA。对土壤中各种细菌、真菌有很好裂解效果,最大限度的保留了微生物 DNA 的多态性。本试剂盒采用我公司特有的腐殖质吸附材料,可高效专一的去除各种腐殖质成分而丝毫不会影响 DNA 的产率,纯度较酚、氯仿抽提法提高数倍。
土壤样品存在大量的抑制因子如腐殖酸、金属离子等,而纯化的DNA 中只要有这些微量物质的存在,都会影响到PCR等酶促反应。本公司的土壤试剂盒采用独特的腐殖酸去除液能够有效去除腐殖酸;吸附柱CG能能有效去除金属等抑制因子,提纯得到的基因组DNA产量大、完整性好,可直接用于各种常规操作,包括酶切、PCR 、文库构建、Southern 杂交等实验
试剂盒组成:
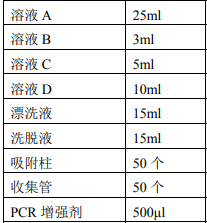
储存温度:室温(15℃-25℃) 干燥保存,2℃-8℃保存时间更长。(注:试剂开封后溶液A、B、C、D需在2-8℃保存,PCR增强剂-20℃保存)
操作步骤:
1、称取土壤样本 0.1-0.5g,在液氮中充分研磨成细粉末,加入 450ul 溶液 A 震荡混匀。也可直接称取样本 0.1-0.5g 于离心管(建议使用 2ml 圆底管),加入 450ul 溶液 A 剧烈震荡混匀1-2min 至没有固体块。 使用液氮研磨效果最佳。
2、加入 50ul 溶液 B 充分颠倒混匀 (不要剧烈震荡),65℃水浴 6min,每 2min 充分颠倒混匀一次。
3、加入 100ul 溶液 C 充分颠倒混匀 (不要剧烈震荡),12000rpm 离心 10min 。
4、将上清转移到新的离心管,12000rpm 离心 2min 。
5、在吸附柱中加入 200ul 溶液 D ,将离心后的上清加入到带有溶液 D 的吸附柱中,用移液器吹吸几次混匀,12000rpm 离心 1min。
6、将收集管中的滤出液混匀后重新吸入吸附柱( 必须),12000rpm 离心 1min。
7、倒掉收集管中的废液,在吸附柱中加入漂洗液 500ul,12000rpm 离心 1min。
8、倒掉收集管中的废液,重复步骤 7 两次(共漂洗三次)。
9、倒掉收集管中的废液,将吸附柱放回收集管,12000rpm 离心 2min 。
10、拿出吸附柱在室温干燥数分钟( 因季节及气候等因素不等),或 50℃干燥 1min。
11、将吸附柱放入一个新的离心管中,加入 50-100ul 洗脱液(65 ℃预热),12000rpm 离心 1min。
12、将离心管中的液体重新加入到吸附柱中,12000rpm 离心 1min。离心管中即为土壤微生物 DNA 溶液。
13、若产物 PCR 效果差,可以适当稀释 DNA 产物,或添加 1/10 体积的 PCR 增强剂。
DNA浓度及纯度检测:
基因组DNA片段的大小与样品保存时间、操作过程中的剪切力等因素有关。提取的DNA片段可用琼脂糖凝胶电泳和紫外分光光度计检测浓度与纯度。可配制0.8-1.0%琼脂糖凝胶,使用λ/HindIII判断基因组的大小,完整的基因组大小应在23kb以上。使用分光光度计检测时, OD260/OD280比值应为1.7–1.9之间,如果洗脱时不使用洗脱缓冲液,而使用去离子水洗脱,比值可能偏低,但并不表明DNA纯度不高。
注意事项:
1、新鲜的土壤样本会得到更高的产率,不同样本在采样前应先查阅相应的最佳保存条件。
2、若溶液中出现浑浊可在 37℃水浴中溶解片刻至清澈,不会影响结果。
3、在需要吸取上清液的步骤中应避免吸到沉淀,否则会堵塞吸附柱,并影响产物纯度。
4、洗脱缓冲液的体积最好不少于 50ul ,体积过小会影响回收效率;建议使用试剂盒附带的洗脱缓冲液,用水洗脱也会损失部分产物;DNA 应保存在-20 ℃避免反复冻融,以防降解。
5、若产物含有腐殖质残余则会严重影响 DNA 的光吸收值,应采取电泳检测和分光光度计检测相结合的方式鉴定。
6、液体试剂避免接触皮肤,若意外接触应立即使用大量清水冲洗。